- Засіб для інгаляційного наркозу [ правити | правити код ]
- У двигунах внутрішнього згоряння [ правити | правити код ]
- У реактивних двигунах [ правити | правити код ]
- У харчовій промисловості [ правити | правити код ]
Наша сеть партнеров Banwar
open wikipedia design.
Оксид азоту 
 загальні систематичне
загальні систематичне
найменування Оксонітрід азоту (I) Хім. формула N 2 O Фізичні властивості стан безбарвний газ молярна маса 44,0128 г / моль щільність 1,98 г / л (при н. У.) енергія іонізації 12,89 ± 0,01 еВ [1] термічні властивості Т. плав. -90,86 ° C Т. кип. -88,48 ° C Тиск пара 51,3 ± 0,1 атм [1] Класифікація Реєстр. номер CAS 10024-97-2 PubChem 948 Реєстр. номер EINECS 233-032-0 SMILES InChI Кодекс Аліментаріус E942 RTECS QX1350000 ChEBI 17045 і 44250 ChemSpider 923 Безпека NFPA 704 Наводяться дані для стандартних умов (25 ° C, 100 кПа) , Якщо не вказано іншого.
Оксид азоту (I) (оксид діазота, закис азоту, звеселяючий газ) - з'єднання з хімічною формулою N2O. Іноді називається «звеселяючим газом» через виробленого ним п'янкого ефекту. При нормальній температурі це безбарвний негорючий газ з приємним солодкуватим запахом і присмаком .
Вперше був отриманий в 1772 році Джозефом Прістлі , Який назвав його « дефлогістрованим нітрозним повітрям » [2] . У 1799 р його досліджував Г. Деві .
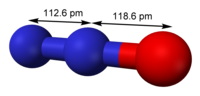
Будова молекули оксиду азоту (I) описується наступними резонансними формами: 
Найбільший внесок вносить N-оксидна форма оксиду азоту (I). Порядок зв'язку NN оцінюється як 2,73, порядок зв'язку NO - як 1,61. Резонансна структура з можливістю протилежного розташування зарядів в молекулі N2O обумовлює низький дипольний момент молекули, що дорівнює 0,161 Д.
безбарвний газ, важчий за повітря ( відносна густина 1,527), з характерним солодкуватим запахом . розчинний в воді (0,6 обсягу N2O в 1 об'ємі води при 25 ° C, або 0,15 г / 100 мл води при 15 ° C), розчинний також в етиловому спирті, ефірі, сірчаної кислоти. При 0 ° C і тиску 30 атм, а також при кімнатній температурі і тиску 40 атм згущається в безбарвну рідина . З 1 кг рідкого закису азоту утвориться 500 л газу. Молекула закису азоту має дипольний момент 0,161 Д , коефіцієнт заломлення в рідкому вигляді дорівнює 1,330 (для жовтого світла з довжиною хвилі 589 нм). Тиск парів рідкого N2O при 20 ° C одно 5150 кПа.
Відноситься до несолеобразующіе оксидів , З водою, з розчинами лугів і кислот не взаємодіє. Нащо, але підтримує горіння: тліюча скіпка, опущена в нього, спалахує, як в чистому кисні. суміші з ефіром , циклопропаном , хлоретаном в певних концентраціях вибухонебезпечні . Оксид азоту (I) є озоноруйнуючим речовиною, а також парниковим газом . У нормальних умовах N2O хімічно інертний, при нагріванні проявляє властивості окислювача:
N 2 O + H 2 → N 2 + H 2 O {\ displaystyle {\ mathsf {N_ {2} O + H_ {2} \ rightarrow N_ {2} + H_ {2} O}}} 2 N 2 O + C → 2 N 2 + C O 2 {\ displaystyle {\ mathsf {2N_ {2} O + C \ rightarrow 2N_ {2} + CO_ {2}}}}
При взаємодії з сильними окислювачами N2O може проявляти властивості відновника:
5 N 2 O + 8 KM n O 4 + 7 H 2 SO 4 → 5 M n (NO 3) 2 + 3 M n SO 4 + 4 K 2 SO 4 + 7 H 2 O {\ displaystyle {\ mathsf {5N_ {2} O + 8KMnO_ {4} + 7H_ {2} SO_ {4} \ rightarrow 5Mn (NO_ {3}) _ {2} + 3MnSO_ {4} + 4K_ {2} SO_ {4} + 7H_ {2} O}}}
При нагріванні N2O розкладається:
2 N 2 O → 2 N 2 + O 2 {\ displaystyle {\ mathsf {2N_ {2} O \ rightarrow 2N_ {2} + O_ {2}}}}
Оксид азоту (I) реагує з амидами металів з утворенням відповідних неорганічних азидів :
2 N a NH 2 + N 2 O → N a N 3 + N a OH + NH 3 {\ displaystyle {\ mathsf {2NaNH_ {2} + N_ {2} O \ rightarrow NaN_ {3} + NaOH + NH_ {3 }}}}
При взаємодії аміаку над каталізатором утворюється азид амонію :
2 NH 3 + N 2 O → N i - A l 2 O 3 NH 4 N 3 + H 2 O {\ displaystyle {\ mathsf {2NH_ {3} + N_ {2} O {\ xrightarrow [{}] {Ni -Al_ {2} O_ {3}}} NH_ {4} N_ {3} + H_ {2} O}}}
Оксид азоту (I) отримують обережним (небезпека вибухового розкладання!) Нагріванням сухого нітрату амонію :
N H 4 N O 3 → N 2 O + 2 H 2 O. {\ Displaystyle {\ mathsf {NH_ {4} NO_ {3} \ rightarrow N_ {2} O + 2H_ {2} O.}}}
Більш зручним способом є нагрівання сульфаминовой кислоти з 73% -й азотною кислотою :
N H 2 S O 2 O H + H N O 3 (73%) → N 2 O + H 2 S O 4 + H 2 O. {\ Displaystyle {\ mathsf {NH_ {2} SO_ {2} OH + HNO_ {3} (73 \%) \ rightarrow N_ {2} O + H_ {2} SO_ {4} + H_ {2} O.} }}
У хімічній промисловості закис азоту є побічним продуктом і для її руйнування використовують каталітичні конвертери, так як виділення у вигляді товарного продукту, як правило, економічно недоцільно.
Закис азоту утворюється як при ферментативному, так і при неферментативне відновленні з окису азоту (II) [3] . У дослідах in vitro було виявлено, що закис азоту утворюється при реакції між окисом азоту (II) і тіол або тиол-містять сполуками [4] . Повідомляється, що освіта N2O з окису азоту було виявлено в цитоплазмі гепатоцитів , Що змушує припускати можливе утворення цього газу в клітинах ссавців в фізіологічних умовах [5] . В організмі бактерій закис азоту утворюється в ході процесу, званого денітрифікацією, і катализируемого нитрооксида-редуктазой. Раніше цей процес передбачався специфічним для деяких видів бактерій і відсутнім у ссавців, але нові дані змушують припускати, що це не так. Було показано, що фізіологічно релевантні концентрації закису азоту інгібують як іонні струми, так і опосередковувані ексайтотоксічность нейродегенеративні процеси, що відбуваються при надмірному збудженні NMDA-рецепторів [6] . Також закис азоту пригнічує біосинтез метіоніну, пригнічуючи активність метіонін-синтетази і швидкість перетворення гомоцистеїну в метіонін і підвищуючи концентрацію гомоцистеїну в культурах лімфоцитів [7] і в біоптатах людської печінки [8] . Хоча закис азоту не є лігандом для гема, і не реагує з тіоловими групами, вона виявляється у внутрішніх структурах гемосодержащіх білків, таких, як гемоглобін , миоглобин , цитохромоксидаза [9] . Здатність закису азоту нековалентно, оборотно змінювати структуру і функції гемосодержащіх білків була показана дослідженням зсуву інфрачервоних спектрів тіолових груп цистеїну гемоглобіну [10] і тим, що закис азоту здатна частково і зупинити пригнічувати функцію цитохромоксидази C [11] . Точні механізми цього Нековалентні взаємодії закису азоту з гемосодержащімі білками і біологічне значення цього явища заслуговують подальших досліджень. В даний час представляється можливим, що ендогенна закис азоту бере участь в регуляції активності NMDA [6] і опіоїдної системи [12] [13] . володіє нейротоксическими властивостями .
Існує два види закису азоту - харчова, або медична для медичного застосування (високого ступеня очищення) і технічна - технічний оксид діазота, в якому є домішки, кількість яких вказується у відповідних техумов (ТУ) на даний газ. «Медична» закис азоту використовується в основному як засіб для інгаляційного наркозу , Знаходить застосування і в харчовій промисловості (наприклад, для виготовлення збитих вершків) в якості пропеллента . Як харчовий продукт, має індекс E942 . Також іноді використовується для поліпшення технічних характеристик двигунів внутрішнього згоряння. У промисловості застосовується як пропеллент і пакувальний газ. Може використовуватися в ракетних двигунах в якості окислювача, а також як єдине паливо в монокомпонентних ракетних двигунах.
Засіб для інгаляційного наркозу [ правити | правити код ]
Малі концентрації закису азоту викликають легке сп'яніння (Звідси назва - «звеселяючий газ»). При вдиханні чистого газу швидко розвиваються стан сп'яніння і сонливість. Закис азоту має слабку наркотичну активність, у зв'язку з чим в медицині її застосовують у великих концентраціях. У суміші з киснем при правильному дозуванні (до 80% закису азоту) викликає хірургічний наркоз . Часто застосовують комбінований наркоз, при якому закис азоту поєднують з іншими засобами для наркозу, анальгетиками , миорелаксантами і т. п. Наприклад, застосовується комбінований наркоз закисом азоту і гексеналом з фентаніловой анальгезией і миорелаксацию дитиліном .
Закис азоту, призначена для медичних потреб (високого ступеня очищення від домішок), не викликає роздратування дихальних шляхів. Будучи, в процесі вдихання, розчиненої в плазмі крові, практично не змінюється і не метаболізується, з гемоглобіном не зв'язується. Після припинення вдихання виділяється (протягом 10-15 хв) через дихальні шляхи в незмінному вигляді. період напіввиведення - 5 хвилин.
Закис азоту використовується для інгаляційного наркозу в хірургії, вона зручна для короткочасного наркозу (і Рауш-наркозу ) В хірургічній стоматології , А також для знеболювання пологів (оскільки слабо впливає на родову діяльність і нетоксична для плода).
Суміш закису азоту з киснем отримують і безпосередньо застосовують за допомогою спеціальних апаратів для наркозу. Зазвичай починають з суміші, що містить 70-80% закису азоту і 30-20% кисню, потім кількість кисню збільшують до 40-50% [ Джерело не вказано 2146 днів ]. Якщо не вдається отримати необхідну глибину наркозу, при концентрації закису азоту 70-75%, додають могутніші наркотичні засоби: фторотан , діетиловий ефір , барбітурати .
Для більш повного розслаблення мускулатури застосовують міорелаксанти , При цьому не тільки посилюється розслаблення м'язів, але також поліпшується протягом наркозу.
Після припинення подачі закису азоту слід щоб уникнути гіпоксії продовжувати давати кисень протягом 4-5 хв.
Застосовувати закис азоту, як і будь-який засіб для наркозу, необхідно з обережністю, особливо при виражених явищах гіпоксії та порушенні дифузії газів в легенях.
Для знеболення пологів користуються методом переривчастої аутоанальгезіі із застосуванням, за допомогою спеціальних наркозних апаратів, суміші закису азоту (75%) і кисню. Породілля починає вдихати суміш при появі передвісників сутички і закінчує вдихання на висоті сутички або по її закінченні.
Для зменшення емоційного збудження, попередження нудоти і блювоти і потенціювання дії закису азоту можлива премедикація внутрішньом'язовим введенням 0,5% -го розчину діазепаму ( седуксена , сибазона ) В кількості 1-2 мл (5-10 мг).
Форма випуску: у металевих балонах місткістю 10 л під тиском 50 атм в зрідженому стані. Балони пофарбовані в сірий колір і мають напис «Для медичного застосування».
При використанні закису азоту для анестезії та прикордонних рівнях вітаміну в B12 розвивається полінейропатія викликана дефіцитом B12. Ефект описаний в роботах [14] [15] та ін. Необхідна терапія фолатами і B12.
У двигунах внутрішнього згоряння [ правити | правити код ]
Закис азоту іноді використовується для поліпшення технічних характеристик двигунів внутрішнього згоряння. У разі автомобільних застосувань речовина, що містить закис азоту, і пальне впорскується у впускний (всмоктуючий) колектор двигуна, що приводить до наступних результатів:
- знижує температуру всмоктується в двигун повітря, забезпечуючи щільний надходить заряд суміші.
- збільшує вміст кисню в надходить заряді (повітря містить лише ~ 23,15 мас.% кисню).
- підвищує швидкість (інтенсивність) згоряння в циліндрах двигуна.
У реактивних двигунах [ правити | правити код ]
Іноді використовується як окислювач в однокомпонентному паливі з етаном , етиленом або ацетиленом в якості палива.
У харчовій промисловості [ правити | правити код ]
У харчовій промисловості з'єднання зареєстровано в якості харчової добавки E942, як пропеллент і пакувальний газ (запобігають псуванню продукту). Закис азоту використовується в основному для розпилення харчових продуктів.
Зберігання: при кімнатній температурі в закритому приміщенні, подалі від вогню.
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0465.html
- ↑ Joseph Priestly. Experiments and observations on different kinds of air . - Vol. 1. - 1775.
- ↑ Neil Hogg, Ravinder J. Singh, B. Kalyanaraman (March 18, 1996). "The role of glutathione in the transport and catabolism of nitric oxide" . FEBS Letters. 382 (3): 223-228. DOI : 10.1016 / 0014-5793 (96) 00086-5 . PMID 8605974 .
- ↑ DeMaster EG, Quast BJ, Redfern B, Nagasawa HT. (Sep 12, 1995). "Reaction of nitric oxide with the free sulfhydryl group of human serum albumin yields a sulfenic acid and nitrous oxide" . Biochemistry. 34 (36): 11494-11499. PMID 7547878 .
- ↑ Jinjoo Hyun, Gautam Chaudhuri, Jon M. Fukuto (September 1, 1999). "The Reductive Metabolism of Nitric Oxide in Hepatocytes: Possible Interaction with Thiols" . Drug Metabolism & Disposition. 27 (9): 1005-1009. PMID 10460799 .
- ↑ 1 2 Jevtović-Todorović V, Todorović SM, Mennerick S, Powell S, Dikranian K, Benshoff N, Zorumski CF, Olney JW. (Apr 1998). "Nitrous oxide (laughing gas) is an NMDA antagonist, neuroprotectant and neurotoxin" . Nat Med. 4 (4): 460-463. PMID 9546794 .
- ↑ Christensen B, Refsum H, Garras A, Ueland PM. (Jun 1992). "Homocysteine remethylation during nitrous oxide exposure of cells cultured in media containing various concentrations of folates" . J Pharmacol Exp Ther. 261 (3): 1096-1105. PMID 1602376 .
- ↑ Koblin DD, Waskell L, Watson JE, Stokstad EL, Eger EI 2nd. (Feb 1982). "Nitrous oxide inactivates methionine synthetase in human liver". Anesth Analg. 61 (2): 75-78. PMID 7198880 .
- ↑ Vijaya Sampath, Xiao-Jian Zhao, and Winslow S. Caughey (Apr 27, 2001). "Anesthetic-like interactions of nitric oxide with albumin and hemeproteins. A mechanism for control of protein function " . The Journal of Biological Chemistry. 276 (17): 13635-13643. DOI : 10.1074 / jbc.M006588200 . PMID 11278308 .
- ↑ Aichun Dong, Ping Huang, Xiao-Jian Zhao, Vijaya Sampath, and Winslow S. Caughey (September 30, 1994). "Characterization of sites occupied by the anesthetic nitrous oxide within proteins by infrared spectroscopy" . The Journal of Biological Chemistry. 269 (39): 23911-23917. PMID 7929038 .
- ↑ Olof Einarsdottir, Winslow S. Caughey (5 Jul 1988). "Interactions of the anesthetic nitrous oxide with bovine heart cytochrome c oxidase. Effects on protein structure, oxidase activity, and other properties " . The Journal of Biological Chemistry. 263 (19): 9199-9205. PMID 2837481 .
- ↑ Gillman MA, Lichtigfeld FJ. (March 1985). "Nitrous oxide acts directly at the mu opioid receptor". Anesthesiology. 62 (3): 375-376. PMID 2983587 .
- ↑ Gillman MA, Lichtigfeld FJ. (Jan 1981). "A comparison of the effects of morphine sulphate and nitrous oxide analgesia on chronic pain states in man" . J Neurol Sci. 49 (1): 41-45. PMID 7205318 .
- ↑ I Chanarin. Cobalamins and nitrous oxide: a review. // Journal of Clinical Pathology. - 1980-10. - Т. 33, вип. 10. - С. 909-916. - ISSN 0021-9746 .
- ↑ RB Layzer. Myeloneuropathy after prolonged exposure to nitrous oxide // Lancet (London, England). - 1978-12-09. - Т. 2, вип. 8102. - С. 1227-1230. - ISSN 0140-6736 .


