- Метанол в бензин [ правити | правити код ]
- Гомологізація метанолу [ правити | правити код ]
- біометанол [ правити | правити код ]
- Застосування в якості авіаційного та ракетного палива [ правити | правити код ]
- Масові отруєння метанолом [ правити | правити код ]
Наша сеть партнеров Banwar
open wikipedia design.
метанол 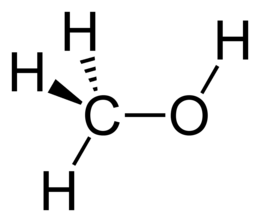
 систематичне
систематичне
найменування Метанол Традиційні назви Метиловий спирт, деревний спирт, карбінол, метілгідрат, гідроксид метилу Хім. формула CH₄O Рац. формула СН3OH стан рідина молярна маса 32,04 г / моль щільність 0,7918 г / см³ динамічна в'язкість 5.9 × 10-4 Па · с енергія іонізації 10,84 ± 0,01 еВ [1] Т. плав. -97 ° C Т. кип. 64,7 ° C 320-380 ° C Т. доп. 6 ° C Т. воспл. 13 ° C Т. свспл. 440 ° C Пр. взрв. 6,98-35,5% Потрійна точка 175,45 K (-97,7 ° C) Кр. крапка 513,15 K (240 ° C), 7,85 МПа ентальпія освіти -238 кДж / моль ентальпія згоряння -726,4 кДж / моль [2] ентальпія плавлення 3167,29 ± 0,01 Дж / моль ентальпія кипіння 37 400 Дж / моль Питома теплота випаровування 37,4 кДж / моль Тиск пара 11,8 кПа (при 20 ° С) pKa ~ 15,5 дипольний момент 1,65 Д Реєстр. номер CAS 67-56-1 PubChem 887 Реєстр. номер EINECS 200-659-6 SMILES InChI RTECS PC1400000 ChEBI 17790 номер ООН 1230 ChemSpider 864 токсичність помірно-токсичний для дрібних тварин, високотоксичний для великих тварин і людини, вражає зоровий нерв 

 NFPA 704 Наводяться дані для стандартних умов (25 ° C, 100 кПа) , Якщо не вказано іншого.
NFPA 704 Наводяться дані для стандартних умов (25 ° C, 100 кПа) , Якщо не вказано іншого.
Метанол (метиловий спирт, деревний спирт, карбінол, метілгідрат, гідроксид метилу) - CH3OH, найпростіший одноатомний спирт, безбарвна отруйна рідина, контоменантами . Метанол - це перший представник гомологічного ряду одноатомних спиртів .
З повітрям в об'ємних концентраціях 6,98-35,5% утворює вибухонебезпечні суміші ( Температура спалаху 8 ° C). Метанол змішується в будь-яких співвідношеннях з водою і більшістю органічних розчинників .
Метанол був вперше виявлений Бойл в 1661 році в продуктах сухої перегонки деревини. Через два століття, в 1834 році, його виділили в чистому вигляді Ж. Б. Дюма і Е. М. Пелиго . Тоді ж була встановлена хімічна формула метанолу. У 1857 році Бертло отримав метанол омиленням метилхлорида.
Відомо кілька способів отримання метанолу: суха перегонка деревини та лігніну , термічний розклад солей мурашиної кислоти, синтез з метану через метилхлорид з наступним омиленням , неповне окислення метану і отримання з синтез-газу [3] . Спочатку в промисловості було освоєно метод отримання метанолу сухою перегонкою деревини, але згодом він втратив своє промислове значення. Сучасне виробництво метанолу з монооксиду вуглецю і водню вперше було здійснено в Німеччині компанією BASF в 1923 році. Процес проводився під тиском 10-35 МПа на цинк-хромовому каталізаторі (ZnO / Cr2O3) при температурі 320-450 ° C [4] . Згодом поширення набув синтез метанолу на медьсодержащих каталізаторах, промотованих цинком, хромом і ін., При 200-300 ° C і тиску 5-10 МПа, розроблений в Англії.
Сучасний промисловий метод отримання - синтез з оксиду вуглецю (II) і водню на мідь-цинковій оксидному каталізаторі при наступних умовах:
- температура - 250 ° C,
- тиск - 7 МПа (= 69,08 атм = 70 Бар = 71,38 кгс / см²)
Схема механізму каталітичного виробництва метанолу складна [5] і сумарно може бути представлена у вигляді реакції:
C O + 2 H 2 → C H 3 O H {\ displaystyle {\ mathsf {CO + 2H_ {2} \ rightarrow CH_ {3} OH}}}
Синтези на основі оксиду вуглецю і водню [6]
ПроцесКаталізаторНосій каталізатораТемпература, ° СТиск, МПаПродукт
Синтез метану Ni ThO2 або MgO 250 ౼ 500 0,1 Метан Синтез метанолу ZnO, Cr2O3, CuO ౼ 200 ౼ 400 5 ౼ 30 Метанол Синтез вищих спиртів Fe, Fe-Cr, Zn-Cr Al2O3, NaOH 180 ౼ 220,
380 ౼ 490
1 ౼ 3, 15 ౼ 25 Метанол і вищі спирти
До промислового освоєння каталітичного способу отримання метанол отримували при сухій перегонці дерева (звідси його назва «деревне спирт»). В даний час цей спосіб неактуальний.
Молекулярна формула - CH4O або CH3-OH, структурна: 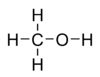
компанія BASF розробила спосіб отримання изобутилового спирту , Заснований на каталітичному гідруванні монооксиду вуглецю і призводить до утворення суміші, що містить 50% метанолу і 11-14% 2-метілпропанола-1, а також інші продукти. BASF припинила виробляти ізобутіловий спирт цим методом після розробки оксосінтеза і нафтохімічного шляху синтезу ізобутанолу [7] .
Виробництво метанолу (в тис. Тонн):
рік США Німеччина світ Ціна продажу( $ / Т) 1928 24 18 140 84,7 1936 97 93 305 88,9 1950 360 120 349 83,1 1960 892 297 3930 99,7 1970 2238 немає даних 5000 89,7 1980 3176 870 15000 236,1 2004 3700 2000 32000 270
У органічної хімії метанол використовується як розчинник.
Метанол використовується в газовій промисловості для боротьби з утворенням гідратів (Через низьку температуру замерзання і хорошою розчинності). В органічному синтезі метанол застосовують для випуску формальдегіду , формаліну , оцтової кислоти і ряду ефірів (Наприклад, МТБЕ і ДМЕ ), ізопрену та ін.
Найбільша його кількість йде на виробництво формальдегіду , Який використовується для виробництва полімерних матеріалів, - в основному для отримання карбамидоформальдегидних і фенолформальдегідних , карбамідних , меламінових та інших синтетичних смол, а останнім часом - і нового пластичного матеріалу - полиформальдегида , Що відрізняється високою механічною міцністю, хімічною стійкістю і легкістю переробки.
Значні кількості CH3OH використовують у лакофарбовій промисловості для виготовлення розчинників при виробництві лаків. Крім того, його застосовують (обмежено через гігроскопічності і відшаровування) як добавку до рідкого палива для двигунів внутрішнього згоряння.
завдяки високому октановим числом , Що дозволяє збільшити ступінь стиснення до 16 [ Джерело не вказано 2417 днів ], Збільшуючи тим самим питому потужність двигуна; метанол використовується для заправки гоночних мотоциклів і автомобілів. Метанол горить в повітряному середовищі, і при його окисленні утворюється двоокис вуглецю і вода :
2 C H 3 O H + 3 O 2 → 2 C O 2 + 4 H 2 O {\ displaystyle {\ mathsf {2CH_ {3} OH + 3O_ {2} \ rightarrow 2CO_ {2} + 4H_ {2} O}}}
У багатьох країнах метанол застосовується в якості денатурує добавки до етанолу при виробництві парфумерії. У Росії використання метанолу в споживчих товарах заборонено [ Джерело не вказано 947 днів ]. У Росії заборонено використання метилового спирту в засобах по догляду за автотранспортом, а також продаж населенню зазначених засобів, що містять метанол [8]
Використовується у паливних елементах . Робота паливних елементів заснована на реакції окислення метанолу на катализаторе в диоксид вуглецю . Вода виділяється на катоді. протони (H +) проходять через протонообмінні мембрану до катода, де вони реагують з киснем і утворюють воду. електрони проходять через зовнішній ланцюг від анода до катода, забезпечуючи енергією зовнішнє навантаження.
реакції:
на аноді
CH 3 OH + H 2 O → CO 2 + 6 H + + 6 e - {\ displaystyle {\ mathsf {CH_ {3} OH + H_ {2} O \ rightarrow CO_ {2} + 6H ^ {+} + 6e ^ {-}}}}
на катоді
1, 5 O 2 + 6 H + + 6 e - → 3 H 2 {\ displaystyle {\ mathsf {1,5O_ {2} + 6H ^ {+} + 6e ^ {-} \ rightarrow 3H_ {2}}} }
Загальна для паливного елемента:
CH 3 OH + 1, 5 O 2 → CO 2 + 2 H 2 O {\ displaystyle {\ mathsf {CH_ {3} OH + 1,5O_ {2} \ rightarrow CO_ {2} + 2H_ {2} O}} }
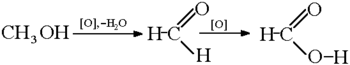
отримання мурашиної кислоти окисленням метанолу:
Метил-трет-бутиловий ефір виходить при взаємодії метанолу з ізобутіленом в присутності кислих каталізаторів (наприклад, іонообмінних смол ):
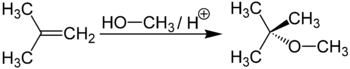
Метил-трет-бутиловий ефір (C5H12O) застосовується в якості добавки до моторних палив, що підвищує октанове число бензинів ( антидетонатор ). Максимальна законодавче зміст МТБЕ в бензинах Європейського союзу - 15%, в Польщі - 5%. У Росії в середньому складі бензинів зміст МТБЕ становить до 12% для АИ92 і до 15% для АІ95, АІ98.
Окремим напрямком є використання метанолу для переетерифікації жирів у виробництві біодизеля [9] . Для отримання біодизеля рослинна олія переетеріфіціруется метанолом при температурі 60 ° C і нормальному тиску приблизно так: 1 т масла + 200 кг метанолу + гідроксид калію або натрію.
отримання диметилового ефіру дегідратацією метанолу при 300-400 ° C і 2-3 МПа в присутності гетерогенних каталізаторів - алюмосиликатов - ступінь перетворення метанолу в диметиловий ефір - 60% або цеолітів - селективність процесу близька до 100%. Диметиловий ефір (C2H6O) - екологічно чисте паливо без вмісту сірки , зміст оксидів азоту в вихлопних газах на 90% менше, ніж у бензину . цетанове число диметилового дизеля більше 55, при тому що у класичного нафтового 38-53.
Метанол в бензин [ правити | правити код ]
Метанол в бензин, ( Methanol-to-Gasoline скорочено MTG), - це хімічний процес виробництва бензину з метанолу.
Процес корисний для виробництва бензину з природного газу або вугілля замість нафти. Процес був розроблений в 70-х роках компанією Mobil (зараз ExxonMobil ). . [10] Вугілля або природний газ спочатку перетворюється в синтез-газ , А потім в метанол. Потім метанол дегідратірующая до диметилового ефіру (ДМЕ). потім диметиловий ефір додатково дегідратірующая на каталізаторі. Хімічна реакція протікає в такий спосіб:
n CH 3 OH → n 2 CH 3 OCH 3 + n 2 H 2 O → koolwaterstoffenformu le: (CH 2) n + n H 2 O {\ displaystyle \ mathrm {n \ CH_ {3} OH \ to \ textstyle {\ frac {n} {2}} \ CH_ {3} OCH_ {3} + \ textstyle {\ frac {n} {2}} \ H_ {2} O \ to \ mathrm {koolwaterstoffen \ formule:} \ (CH_ { 2}) _ {n} + n \ H_ {2} O}} : Cтепень перетворення метанолу в вуглеводні з п'ятьма або більше атомами вуглецю 80%. [11] Каталізатором зазвичай є цеоліт , наприклад ZSM-5 . ZSM-5 втрачає свою активність через накопичення вуглецю. Потім каталізатор необхідно регенерувати шляхом випалювання вуглецю при 500 ° С. Кількість можливих регенераций обмежена, і в кінцевому підсумку каталізатор необхідно замінити.
З 1000 тонн метанолу в процесі буде отримано 387 тонн бензину, 46 тонн зрідженого нафтового газу, 7 тонн паливного газу і 560 тонн води, котор. реціркуліруeтся в якості технічної води.
Гомологізація метанолу [ правити | правити код ]
Гомологізація , Тобто перетворення органічної сполуки в свій гомолог шляхом впровадження однієї або декількох метиленових груп, для спиртів була вперше здійснена в 1940 році - на основі метанолу каталітичним шляхом під впливом високого тиску був синтезований етанол [4] :
CH 3 OH + CO + 2 H 2 → C o 2 (CO) 8 CH 3 CH 2 OH + H 2 O {\ displaystyle {\ mathsf {CH_ {3} OH + CO + 2H_ {2} {\ xrightarrow [{ }] {Co_ {2} (CO) _ {8}}} CH_ {3} CH_ {2} OH + H_ {2} O}}}
Реакція гомологізаціі за своїм механізмом близька реакції гідроформілірованія алкенов і в даний час за допомогою модифікованих каталізаторів кобальту і рутенію і додавання йодид-іонів в якості промоторів вдається домогтися 90% виходу з етанолу [4] .
Вихідний метанол також отримують з окису вуглецю (каталізатори на основі оксидів міді і цинку, тиск 5-10 МПа, температура 250 ° C) [4] , Так що загальна схема виглядає наступним чином:
C + H 2 O → CO + H 2 → - H 2 OCO + H 2 CH 3 CH 2 OH {\ displaystyle {\ mathsf {C + H_ {2} O \ rightarrow CO + H_ {2} {\ xrightarrow [{ -H_ {2} O}] {CO + H_ {2}}} CH_ {3} CH_ {2} OH}}}
Побічними продуктами реакції в разі синтезу етанолу будуть ацетальдегід , етилен і діетиловий ефір .
У 1940 році вперше була здійснена катализируемая оксидом кобальту при тиску 600 атм реакція метанолу з синтез-газом з утворенням в якості основного продукту етанолу ... Згодом ця реакція, названа гомологізаціей, викликала величезний інтерес у хіміків. Її привабливість пов'язана з можливістю отримання етилену з вугільного сировини Застосування в якості каталізаторів карбонила кобальту Со2 (СО) 8 дозволило знизити тиск до 250 атм, при цьому ступінь перетворення метанолу склала 70%, а основний продукт - етанол утворювався з селективністю 40%. Надалі були запропоновані більш селективні каталізатори на основі сполук кобальту і рутенію з добавками фосфінових лігандів і було встановлено, що реакцію можна прискорити за допомогою введення промоторів - йодид-іонів. В даний час вдалося досягти селективності по етанолу 90%. Хоча механізм гомологізаціі до кінця не встановлено, можна вважати, що він близький до механізму карбонилирования метанолу [4] .
біометанол [ правити | правити код ]
Промислове культивування та біотехнологічна конверсія морського фітопланктону розглядається як одне з найбільш перспективних напрямків в області отримання біопалива [12] .
На початку 80-х низкою європейських країн спільно розроблявся проект, орієнтований на створення промислових систем з використанням прибережних пустельних районів. Здійсненню цього проекту завадило загальносвітове зниження цін на нафту .
первинне виробництво біомаси здійснюється шляхом культивування фітопланктону в штучних водоймах, створюваних на морському узбережжі.
Вторинні процеси являють собою метанове бродіння біомаси і подальше гидроксилирование метану з отриманням метанолу.
Основними аргументами на користь використання мікроскопічних водоростей є наступні:
- висока продуктивність фітопланктону (до 100 т / га в рік);
- у виробництві не використовуються ні родючі грунти, ні прісна вода;
- процес не конкурує з сільськогосподарським виробництвом;
- енерговіддача процесу досягає 14 [ чого? ] На стадії отримання метану і 7 [ чого? ] На стадії отримання метанолу;
З точки зору отримання енергії дана біосистеми має істотні економічні переваги в порівнянні з іншими способами перетворення сонячної енергії .
При застосуванні метанолу в якості палива слід зазначити, що об'ємна і масова енергоємність (теплота згоряння) метанолу (питома теплота згоряння = 22,7 МДж / кг) на 40-50% менше, ніж бензину, однак при цьому теплова спіртовоздушних і бензинових топлівовоздушних сумішей при їх згоранні в двигуні різниться незначно з тієї причини, що високе значення теплоти випаровування метанолу сприяє поліпшенню наповнення циліндрів двигуна і зниження його теплонапряженности, що призводить до підвищення повноти згоряння піртовоздушной суміші. В результаті цього потужність двигуна підвищується на 7-9%, а крутний момент на 10-15%. Двигуни гоночних автомобілів, що працюють на метанолі з більш високим октановим числом , Ніж бензин, мають ступінь стиснення , Що перевищує 15: 1 [13] [14] , В той час як в звичайному ДВС з іскровим запалюванням ступінь стиснення для неетильованого бензину як правило, не перевищує 11,5: 1. Метанол може використовуватися як в класичних двигунах внутрішнього згоряння , Так і в спеціальних паливних елементах для отримання електрики.
Окремо слід відзначити збільшення індикаторного ККД при роботі класичного ДВС на метанолі в порівнянні з його роботою на бензині. Такий приріст викликаний зниженням теплових втрат і може досягати одиниць відсотків.
паливо щільність
енергії
суміш повітря
з паливом питома
енергія
суміші повітря
з паливом
питома теплотавипаровування Октанове число (RON) Октанове число (MON) бензин
32 МДж / л 14,6 2,9 МДж / кг повітря 0,36 МДж / кг 91-99 81-89 Бутанол-1 29,2 МДж / л 11,1 3,2 МДж / кг повітря 0,43 МДж / кг 96 78 етанол 19,6 МДж / л 9,0 3,0 МДж / кг повітря 0,92 МДж / кг 132 89 Метанол 16 МДж / л 6,4 3,1 МДж / кг повітря 1,2 МДж / кг 156 92
недоліки
- метанол труїть алюміній . Проблемним є використання алюмінієвих карбюраторів і інжекторних систем подачі палива в ДВС . Це відноситься в основному до метанолу-сирцю, який містить значні кількості домішок мурашиної кислоти і формальдегіду. Технічно чистий метанол, що містить воду, починає реагувати з алюмінієм при температурі вище 50 ° C, а зі звичайною вуглецевою сталлю не реагує зовсім.
- гідрофільність . метанол втягує воду , Що є причиною розшарування паливних сумішей бензин-метанол.
- Метанол, як і етанол, підвищує пропускну здатність пластмасових випарів для деяких пластмас (Наприклад, щільного поліетилену ). Ця особливість метанолу підвищує ризик збільшення емісії летючих органічних речовин , Що може привести до зменшення концентрації озону і посилення сонячної радіації .
- Зменшена летючість при холодній погоді: мотори, що працюють на чистому метанолі, можуть мати проблеми з запуском при температурі нижче +10 ° C і відрізнятися підвищеною витратою палива до досягнення робочої температури. Дана проблема проте, легко вирішується додаванням в метанол 10-25% бензину.
Низький рівень домішок метанолу може бути використаний в паливі існуючих транспортних засобів з використанням належних інгібіторів корозії. Т. н. європейська директива якості палива (European Fuel Quality Directive) дозволяє використовувати до 3% метанолу з рівною кількістю присадок в бензині, що продається в Європі. Сьогодні в Китаї використовується більше 1000 млн галонів метанолу в рік в якості транспортного палива в сумішах низького рівня, використовуваних в існуючих транспортних засобах, а також високорівневі суміші в транспортних засобах, призначених для використання метанолу в якості палива.
Крім застосування метанолу в якості альтернативи бензину існує технологія застосування метанолу для створення на його базі вугільної суспензії, яка в США має комерційне найменування « Метакол »(Methacoal [16] ). Таке паливо пропонується як альтернатива мазуту , Широко використовуваного для опалення будівель ( топковий мазут ). така суспензія на відміну від водоуглеродного палива не вимагає спеціальних котлів і має більш високу енергоємність. З екологічної точки зору таке паливо має менший « вуглецевий слід », Ніж традиційні варіанти синтетичного палива одержуваного з вугілля з використанням процесів, де частина вугілля спалюється під час виробництва рідкого палива.
Застосування в якості авіаційного та ракетного палива [ правити | правити код ]
Під час Другої Світової війни Німеччина використовувала метанол в якості палив і присадок до палива для потреб люфтваффе . Система форсування авіаційного поршневого двигуна MW 50 представлялa собою суміш 50% води і 50% метанолу яка розпорошуватися в нагнітач авіаційних двигунів, головним чином через її Антидетонаційна ефекту, дозволяючи створювати більший тиск в циліндрах. Еe побічним ефектом було внутрішнє охолодження двигуна. Ефект застосування MW 50 був драматичним. Просте включення системи дозволяло двигуну поглинути більше повітря завдяки більш холодному тілу ефекту, тим самим збільшуючи продуктивність приблизно на 100 л. с. для двигунів BMW 801 і DB 605 . На додаток до цього MW-50 дозволяв нагнітача працювати на більш високій швидкості і тиску, викликаючи комбіноване збільшення потужності двигунів до 500 л. с. (Для двигунів Юнкерс Юмо 211 )
Hемецкий ракетний винищувач -перехватчік часів Другої Світової Війни Me-163 МАВ рідінній ракетний двигун, в Який подавати 80-процентна перекис водних и рідкий каталізатор (розчин перманганату калію або суміш метанолу, гідразін-гідрату и води). У камері згоряння перекис водню розкладалася з утворенням великого обсягу перегрітої парогазової суміші, створюючи потужну реактивну тягу.
Метанол - безбарвна рідина з різким запахом етилового спирту [17] . Температура кипіння +64,7 ° C.
Питома вага при 0 ° / 0 ° = 0,8142 ( Копп ); при 15 ° / 15 ° = 0,79726; при 25 ° / 25 ° = 0,78941 (Perkin); при 64,8 ° / 4 ° = 0,7476 (Шифф); при 0 ° / 4 ° = 0,81015; при 15,56 ° / 4 ° = 0,79589 (Dittmar і Fawsitt). Капілярна постійна при температурі кипіння a ² = 5,107 (Шифф); Критична температура 241,9 ° (Шмідт). пружність пара при 15 ° = 72,4 мм; при 29,3 ° = 153,4 мм; при 43 ° = 292,4 мм; при 53 ° = 470,3 мм; при 65,4 ° = 756,6 мм (Д. Коновалов). Теплота горіння дорівнює 170,6, теплота освіти 61,4 (Штоман, Клебер і лангбейніт).
Метанол змішується в усіх відношеннях з водою, етиловим спиртом і ефіром; при змішуванні з водою відбувається стиснення і розігрівання. Горить синюватим полум'ям. Подібно етилового спирту - сильний розчинник, внаслідок чого в багатьох випадках може заміняти етиловий спирт . Безводний метанол, розчиняючи невелику кількість мідного купоросу, набуває блакитно-зелене забарвлення, тому безводних мідним купоросом можна користуватися для відкриття слідів води в метанолі; але він не розчиняє CuSO4 ∙ 7H2O (Клепль).
Метанол (на відміну від етанолу) з водою не утворює азеотропной суміші, в результаті чого суміші вода-метанол можуть бути розділені ректифікаційної перегонкою. Температура кипіння водних розчинів метанолу:
Молярна частка метанолу% Т кип. ° C, 760 мм. рт. ст. 0 100 5 92,8 10 88,3 15 84,8 20 82 25 80,1 30 78,2 35 76,8 40 75,6 45 74,5 50 73,5 55 72,4 60 71,6 65 70 , 7 70 69,8 75 68,9 80 68 85 67,1 90 66,3 95 65,4 100 64,6
Метанол дає з багатьма солями сполуки, подібні кристалогідратів ( сольвати ), Наприклад: CuSO4 ∙ 2СН3ОН; LiCl ∙ 3СН3ОН; MgCl2 ∙ 6СН3ОН; CaCl2 ∙ 4СН3ОН є шестисторонні кристали, що розкладаються водою, але не руйнуються нагріванням до 100 ° (Kane). З'єднання ВаО ∙ 2СН3ОН ∙ 2Н2O виходить у вигляді блискучих призм при розчиненні ВаО у водному метанолі і випаровуванні на холоді отриманої рідини при кімнатній температурі (Форкранд).
З їдкими лугами метанол утворює сполуки 5NaOH ∙ 6СН3ОН; 3KOH ∙ 5СН3OH (Геттіг). При дії металевих калію і натрію легко дає алкоголяти , Що приєднують до себе кристалізаційний метанол і іноді воду.
При пропущенні парів метанолу через червоного напружену трубку виходить C2H2 і інші продукти ( Бертло ). При пропущенні парів метанолу над розжареним цинком виходить окис вуглецю , водень і невеликі кількості болотного газу (Jahn). повільне окислення парів метанолу за допомогою розпеченої платинової або мідного дроту являє кращий засіб для отримання великих кількостей формальдегіду: 2СН3ОН + О2 = 2НСНО + 2Н2О. При дії хлористого цинку і високої температури метанол дає воду і алкани, а також невеликі кількості гексаметілбензола ( лебідь і Грін). Метанол, нагріте з нашатирем в запаяній трубці до 300 °, дає моно-, ди-і триметиламіну (Бертло).
При пропущенні парів метанолу над KOH при високій температурі виділяється водень і утворюються послідовно форміат, ацетат і, нарешті, карбонат калію.
концентрована сірчана кислота дає метілсерную кислоту CH3HSO4, яка при подальшому нагріванні з метанолом дає метиловий ефір . При перегонці метанолу з надлишком сірчаної кислоти в відгін переходить діметілсерная кислота (CH3) 2SO4 . При дії сірчаного ангідриду SO3 виходить CH (OH) (SO3H) 2 і CH2 (SO3H) 2 (див. метилен ).
Метанол при дії соляної кислоти , Пятихлористого фосфору і хлористої сірки дає хлористий метил СН3Cl. Дією HBr і H2SO4 отримують бромистий метил. Підкислений 5% -й сірчаної кислотою і підданий електролізу, метанол дає СО2, СО, муравьінометіловий ефір, метілсерную кислоту і метілаль СН2 (ОСН3) 2 (Ренар). При нагріванні метанолу з хлористого-водневими солями ароматичних підстав (аніліном, ксілідіном, піперидин) легко відбувається заміщення водню в бензольному ядрі метилом (Гофман, Ладенбург); реакція має велике технічне значення при приготуванні метілрозаніліна та інших штучних пігментів.
У вільному стані [18] метиловий спирт зустрічається в природі лише зрідка і в дуже невеликих кількостях (наприклад в ефірних маслах), але похідні його поширені досить широко. Так, наприклад, багато рослинні масла містять складні ефіри метилового спирту: масла гаултеріі - метиловий ефір саліцилової кислоти С6H4 (OH) COOCH3, масло жасмину - метиловий ефір антраниловой кислоти С6H4 (NH2) COOCH3. Прості ефіри метилового спирту надзвичайно часто зустрічаються серед природних речовин, наприклад природних барвників, алкалоїдів і т. П.
У промисловості метиловий спирт раніше отримували виключно шляхом сухої перегонки дерева. У рідких погонах, так званому «деревному оцті», поряд з оцтовою кислотою (10%), ацетоном (До 0,5%), ацетальдегідом , алліловий спиртом , метилацетат , аміаком и амінами міститься також 1,5-3% метилового спирту. Для відділення оцтової кислоти продукти сухої перегонки пропускають через гарячий розчин вапняного молока , Що затримує її у вигляді уксуснокислого кальцію . Значно важче відокремити метиловий спирт від ацетону, так як температури кипіння їх дуже близькі (ацетон, т.кіп. 56,5 °; метиловий спирт, т.кіп. 64,7 °). Все ж шляхом ретельної ректифікації на відповідних колонах в техніці вдається майже повністю відокремити метиловий спирт від супутнього йому ацетону. Неочищений метиловий спирт називається також «деревним спиртом».
Метанол - найнебезпечніший отрута, прийом всередину близько 10 мл метанолу може призводити до важкого отруєння (Один із наслідків - сліпота ) [19] , Потрапляння в організм більш 80-150 мілілітрів метанолу (1-2 мілілітра чистого метанолу на кілограм тіла [20] ) зазвичай смертельно [21] . Відноситься до 2 класу небезпеки . [22] LD50 для тварин - від одиниць до десятка г / кг [23] . Токсичний ефект метанолу розвивається протягом декількох годин, і ефективні антидоти здатні зменшити наноситься шкода [19] . Небезпечний для життя не тільки чистий метанол, але і рідини, що містять цю отруту навіть у порівняно невеликій кількості.
У США максимальне допустиме добове вживання метанолу ( референтна доза ), Маючи на увазі несвязанное з будь-якими ефектами на здоров'я, встановлено в розмірі 2 мг на кг ваги тіла (з 1988 року) [24] .
Гранично допустима концентрація метанолу в повітрі робочої зони дорівнює 5 мг / м³ [25] (У ізопропілового спирту 10 мг / м³ [26] , у етанолу - 1000 мг / м³), ГДК в повітрі населених місць дорівнює 1,0 мг / м³ (у ізопропілового спирту 0,6 мг / м³, у етанолу - 5 мг / м³ [27] ).
Найбільш легка форма отруєння характеризується наявністю головного болю, загальною слабкістю, нездужанням, ознобом, нудотою, блювотою.
Токсичність метанолу полягає в тому, що при попаданні в організм він з плином часу окислюється до отруйного формальдегіду , Який викликає сліпоту, шкідливо впливає на нервову систему, вступає в реакції з білками. Відбувається так званий летальний синтез .
Особлива небезпека метанолу пов'язана з тим, що по запаху і смаку він не відрізняється від етилового спирту, через що і відбуваються випадки його вживання всередину. Йодоформна реакція: з етиловим спиртом випаде йодоформ жовтого кольору, а з метанолом нічого не випадає (реакція не підходить для визначення вмісту метанолу в розчині етанолу) [28] .
Як зазначено в керівництві для лікаря швидкої медичної допомоги, при отруєнні метанолом антидотом є етанол , Який вводиться внутрішньовенно в формі 10% розчину крапельно або 30-40% розчину перорально з розрахунку 1-2 грами розчину на 1 кг ваги на добу [29] . Корисний ефект в цьому випадку забезпечується відволіканням ферменту АДГ I на окислення екзогенного етанолу [30] .
Слід врахувати, що при недостатньо точному діагнозі за отруєння метанолом можна прийняти алкогольну інтоксикацію, отруєння 1,2-дихлоретаном або чотирихлористого вуглецем - в цьому випадку введення додаткової кількості етилового спирту небезпечно [29] .
Отруєння метанолом досить часті. Так, в США протягом 2013 року зафіксовано 1747 випадків [31] .
Масові отруєння метанолом [ правити | правити код ]
Відомо безліч масових отруєнь метанолом. Джерелом метанолу можуть бути фальсифіковані незамерзаючі рідини для автомобілів [32] , Контрафактний алкоголь [33] , Метанол, що видається за етиловий спирт.
- ↑ http://www.cdc.gov/niosh/npg/npgd0397.html
- ↑ https://sites.google.com/site/ellesmerealevelchemistry/module-3-periodic-table-energy/3-2-physical-chemistry-1/3-2-1-enthalpy-changes/3-2-1- d-enthalpy-change-definitions
- ↑ М.М.Караваев, В.Е.Леонов, І.Г. Попов, Е.Т.Шепелев. Технологія синтетичного метанолу. - Москва: Хімія, 1984. - 239 с.
- ↑ 1 2 3 4 5 Е.А.Караханов. СИНТЕЗ-ГАЗ ЯК АЛЬТЕРНАТИВА НАФТИ. Частина II. Метанол і синтези на його основі // Соросівський освітній журнал. - 1997. - № 12. - С. 65-69.
- ↑ Yurieva TM et al. Mechanisms for hydrogenation of acetone to isopropanol and of carbon oxides to methanol over copper-containing oxide catalysts // Journal of Molecular Catalysis A: Chemical. - 1996. - Vol. 113, no. 3. - С. 455-468.
- ↑ А.К.Мановян. Технологія переробки природних енергоносіїв. - Москва: Хімія, Колос, 2004. - 456 с. - ISBN 5-98109-004-9 , 5-9532-0219-97.
- ↑ Помилка у Виноску ? Невірний тег <ref>; для виносок ullmann не вказано текст
- ↑ Постанова головного державного лікаря Російської Федерації від 11.07.2007 N 47
- ↑ Біодизель (неопр.). Російська Національна біопаливних Асоціація. Дата обігу 12 вересня 2010 року.
- ↑ DKRW Selects ExxonMobil's Methanol-to-Gasoline (MTG) Technology for Coal-to-Liquids Project (неопр.). Green Gas Congress (17 грудня 2007).
- ↑ THE PRODUCTION OF METHANOL AND GASOLINE (неопр.). New Zealand Institute of Chemistry.
- ↑ Waganer K. Mariculture on land. - Biomass, 1981
- ↑ Ethanol and Energy Independence - Journey to Energy Independence
- ↑ Pierre Duret. New Generation of Engine Combustion Processes for the Future ? , 2002
- ↑ Internal Combustion Engines, Edward F. Obert, 1973
- ↑ Energy Citations Database (ECD) - - Document # 6329346
- ↑ METHANOL (CAS Reg. No. 67-56-1), INTERIM ACUTE EXPOSURE GUIDELINE LEVELS (AEGLs) // EPA, 2005: Додати "Odor: Alcoholic odor; pungent odor when crude; pungent"
- ↑ П. Каррер (1960), «Курс органічної хімії», стор. 117.
- ↑ 1 2 Vale A. Methanol (неопр.) // Medicine. - 2007. - Т. 35, № 12. - С. 633-634. - DOI : 10.1016 / j.mpmed.2007.09.014 .
- ↑ Methanol Poisoning Overview (неопр.). Antizol. Читальний зал 5 жовтня 2011 року.
- ↑ http://www.epa.gov/chemfact/s_methan.txt «Humans - Ingestion of 80 to 150 mL of methanol is usually fatal to humans (HSDB 1994).»
- ↑ СанПіН 2.1.4.1074-01 (неопр.). mhts.artinfo.ru. Дата обігу 7 червня 2019.
- ↑ http://www.epa.gov/chemfact/s_methan.txt B. Acute Toxicity 2. Animals - Oral LD50
- ↑ Methanol (CASRN 67-56-1)
- ↑ ГН 2.2.5.1313-03 - ГДК шкідливих речовин в повітрі робочої зони - www.dioxin.ru (неопр.). www.dioxin.ru. Дата обігу 12 листопада 2016.
- ↑ ГОСТ 9805-84. Спирт ізопропіловий. Технічні умови. Цей стандарт поширюється на ізопропіловий спирт, одержуваний гидратацией пропілену
- ↑ Nordoc.ru - ГН 2.1.6.695-98. Гранично допустимі концентрації (ГДК) забруднюючих речовин в атмосферному повітрі населених місць
- ↑ як відрізнити етанол від метанолу? - Форум хіміків на XuMuK.ru
- ↑ 1 2 гострі отруєння - Електронне довідкове керівництво для лікаря швидкої медичної допомоги. глава 15
- ↑ Алкогольдегідрогеназу ССАВЦІВ - Об'єкт МОЛЕКУЛЯРНОЇ МЕДИЦИНИ Читальний зал 18 жовтня 2011 року. / Успіхи біологічної хімії, т. 43, 2003, с. 3-18
- ↑ Ferri Fred F. Ferri's Clinical Advisor 2017: 5 Books in 1 : [ англ. ]. - Elsevier Health Sciences, 2016. - P. 794. - ISBN 9780323448383 .
- ↑ Чим «незамерзайка» небезпечна для здоров'я водіїв
- ↑ 1 2 У Чехії розслідують історію про масове отруєння контрафактним алкоголем
- ↑ Os esquecidos do metílico (Галіс.). Galicia Hoxe. Дата звернення 23 червня 2015.
- ↑ Vuelve el caso del alcohol adulterado (Ісп.). La Voz de Vigo. Дата звернення 20 грудня 2016.
- ↑ Deaths From Illegal Liquor Rise to 308 in Southern India (неопр.). The New York Times (10 липня 1981). Дата звернення 20 грудня 2016.
- ↑ Hanumantharaya CH. The Big Hooch Tragedy , Talk Magazine (14 грудня 2012). Читальний зал 4 січня 2015 року. Дата звернення 20 грудня 2016.
- ↑ Roberto Suro. Italy acting to end the sale of methanol-tainted wine (9 квітня 1986). Дата звернення 20 грудня 2016.
- ↑ Rupert Millar. Italian methanol scandal (неопр.). thedrinksbusiness.com (17 серпня 2011). Дата звернення 20 грудня 2016.
- ↑ 122 salvadoreños mueren tras ingerir aguardiente adulterado con metanol (Ісп.). El País (13 de octubre de 2000). Дата звернення 20 грудня 2016.
- ↑ 10 días sin alcohol - Ley seca en El Salvador (Ісп.). La Nación (13 de octubre de 2000). Дата звернення 20 грудня 2016.
- ↑ Licor "Trueno" no contenía metanol, revela Fiscalía (Ісп.). El Diario de Hoy (21 de agosto de 2001). Дата звернення 20 грудня 2016.
- ↑ Число померлих від отруєння «глід» в Іркутську зросла до 78 . Дата звернення 16 квітня 2018.


